掌握!制取氧气的三大化学反应方程式
作者:佚名 来源:未知 时间:2024-11-14
在化学实验中,制取氧气是一项重要的操作。氧气,作为无色无味的气体,在自然界分布最广,是生命活动中不可或缺的元素。本文将介绍三种常用的制取氧气的化学方法,并通过化学方程式、实验步骤及注意事项、以及这些方法在生活和工业中的应用等多个维度进行深入探讨。
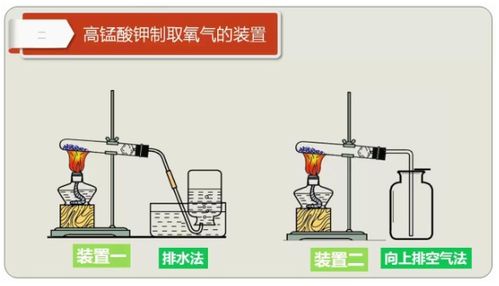
首先,我们来看第一种方法:加热高锰酸钾制取氧气。高锰酸钾(KMnO₄)在加热的条件下可以分解生成锰酸钾(K₂MnO₄)、二氧化锰(MnO₂)和氧气(O₂)。这一过程的化学方程式为:2KMnO₄ == K₂MnO₄ + MnO₂ + O₂↑(加热)。
在实验操作中,加热高锰酸钾制取氧气需要注意一些细节。首先,要确保实验装置的气密性良好,防止氧气泄漏。其次,在安装大试管时,试管应略微倾斜,使试管口低于试管底,这样可以防止加热时药品所含有的少量水分变成水蒸气,在管口处冷凝成水滴而倒流,从而避免试管破裂。加热时还需注意受热均匀,以防试管因局部温度过高而破裂。最后,在停止制氧气时,应先撤出导气管,再移去酒精灯,以防止水槽中的水因试管内气压减小而倒流至热的试管中,造成试管破裂。
加热高锰酸钾制取氧气的方法在实验室中较为常用,但需要注意操作的安全性。高锰酸钾是一种强氧化剂,与可燃物接触可能引发火灾。因此,在实验过程中,应远离可燃物,并在通风良好的环境下进行操作。
接下来,我们来看第二种方法:氯酸钾分解制取氧气。氯酸钾(KClO₃)在二氧化锰(MnO₂)的催化下加热分解,可以生成氯化钾(KCl)和氧气。这一过程的化学方程式为:2KClO₃ == 2KCl + 3O₂↑(MnO₂催化加热)。
氯酸钾分解制取氧气的方法同样需要注意实验装置的气密性、试管的倾斜角度、加热的均匀性以及停止加热时的操作顺序。与加热高锰酸钾不同的是,氯酸钾分解制得的氧气中可能含有少量的氯气(Cl₂)、臭氧(O₃)和微量的二氧化氯(ClO₂)。因此,在实验过程中,需要采取适当的措施来净化氧气,以确保其纯度。
此外,氯酸钾也是一种强氧化剂,与可燃物接触同样可能引发火灾。因此,在实验过程中,同样需要远离可燃物,并在通风良好的环境下进行操作。
最后,我们来看第三种方法:过氧化氢溶液催化分解制取氧气。过氧化氢(H₂O₂)在二氧化锰(MnO₂)的催化下可以分解生成水和氧气。这一过程的化学方程式为:2H₂O₂ == 2H₂O + O₂↑(MnO₂催化)。
过氧化氢分解制取氧气的方法在实验室中同样常用。与加热高锰酸钾和氯酸钾分解相比,过氧化氢分解制取氧气的方法具有操作简便、安全性高的优点。在实验过程中,只需将过氧化氢溶液倒入试管中,加入适量的二氧化锰作为催化剂,即可观察到氧气的生成。
需要注意的是,虽然过氧化氢分解制取氧气的方法操作简便,但在实验过程中仍需注意一些细节。例如,要确保实验装置的气密性良好,防止氧气泄漏;在加入二氧化锰催化剂时,要轻轻振荡试管,使催化剂均匀分散在溶液中;在收集氧气时,要使用排水法或向上排空气法,以确保氧气的纯度。
除了以上三种常用的制取氧气的方法外,还有一些其他的方法也可以用于制取氧气。例如,电解水法可以将水分解为氢气和氧气;过氧化钠与二氧化碳反应也可以生成氧气。这些方法各有优缺点,适用于不同的场合和需要。
在生活和工业中,制取氧气的方法有着广泛的应用。在医疗领域,氧气被用于治疗各种缺氧症状,如呼吸系统疾病、心血管疾病等。在工业领域,氧气被用于焊接、切割、冶炼等工艺过程中,以提高生产效率和产品质量。此外,氧气还被用于食品保鲜、污水处理等领域,发挥着重要的作用。
然而,不同场合和需要下对氧气的制取方法有着不同的要求。例如,在医疗领域,需要制取高纯度的氧气以满足治疗需要;在工业领域,则需要制取大量的氧气以提高生产效率。因此,在选择制取氧气的方法时,需要根据具体情况进行综合考虑,选择最适合的方法。
此外,制取氧气的过程中还需要注意环保和安全性问题。例如,在制取氧气的过程中可能会产生一些有害气体或污染物,需要采取适当的措施进行处理和净化;同时,在操作过程中也需要注意防火、防爆等安全问题,以确保实验和生产的顺利进行。
综上所述,制取氧气的方法有多种多样,每种方法都有其特点和适用范围。在实验室中,加热高锰酸钾、氯酸钾分解和过氧化氢分解是三种常用的制取氧气的方法;在生活和工业中,制取氧气的方法则更加多样化,需要根据具体情况进行选择和应用。无论采用哪种方法制取氧气,都需要注意实验或生产过程中的安全性和环保问题,以确保制取出的氧气能够满足各种需求并发挥最大的作用。
- 上一篇: 列举法实施的三大关键步骤
- 下一篇: 揭秘《论语》中的“迁怒不二过”:深刻含义何在?













































